脳の病気に光を!ヒスタミンH3受容体の謎が解明され、新しい治療薬開発に期待
「脳の病気」と聞くと、多くの人が不安を感じるかもしれません。アルツハイマー病やパーキンソン病、ADHD(注意欠如・多動症)など、中枢神経系に関わる病気は、私たちの日常生活に大きな影響を及ぼします。そんな病気の治療法を開発するために、日々多くの研究者が努力を続けています。
今回、東京理科大学の研究グループが、これらの神経疾患の治療ターゲットとして注目されている「ヒスタミンH3受容体(H3R)」というタンパク質の、とても大切な秘密を解き明かしました。この発見は、もしかしたら将来、脳の病気に悩む多くの人々に新しい希望をもたらすかもしれません。
ヒスタミンH3受容体(H3R)ってどんなもの?
私たちの体には、細胞の外からの信号を受け取って、細胞の中に伝える「受容体」というアンテナのようなタンパク質がたくさんあります。その中でも特に重要なのが「Gタンパク質共役型受容体(GPCR)」と呼ばれるグループで、H3Rもその一つです。
H3Rは主に脳の前頭葉に存在し、神経伝達物質の放出を抑える働きをしています。このH3Rの働きが、食欲の調整や、ADHD、統合失調症、アルツハイマー病といった様々な神経疾患に関わっていると考えられているため、H3Rの働きをうまくコントロールできれば、これらの病気の新しい治療薬が生まれるかもしれません。
H3Rは、特別な刺激がなくても常に少しだけ活性化している「恒常的活性」という性質を持っていることが知られています。しかし、この恒常的活性がどのようにして起こるのか、その詳しい仕組みはこれまでほとんど分かっていませんでした。
研究の背景:謎に包まれたH3Rの活性化
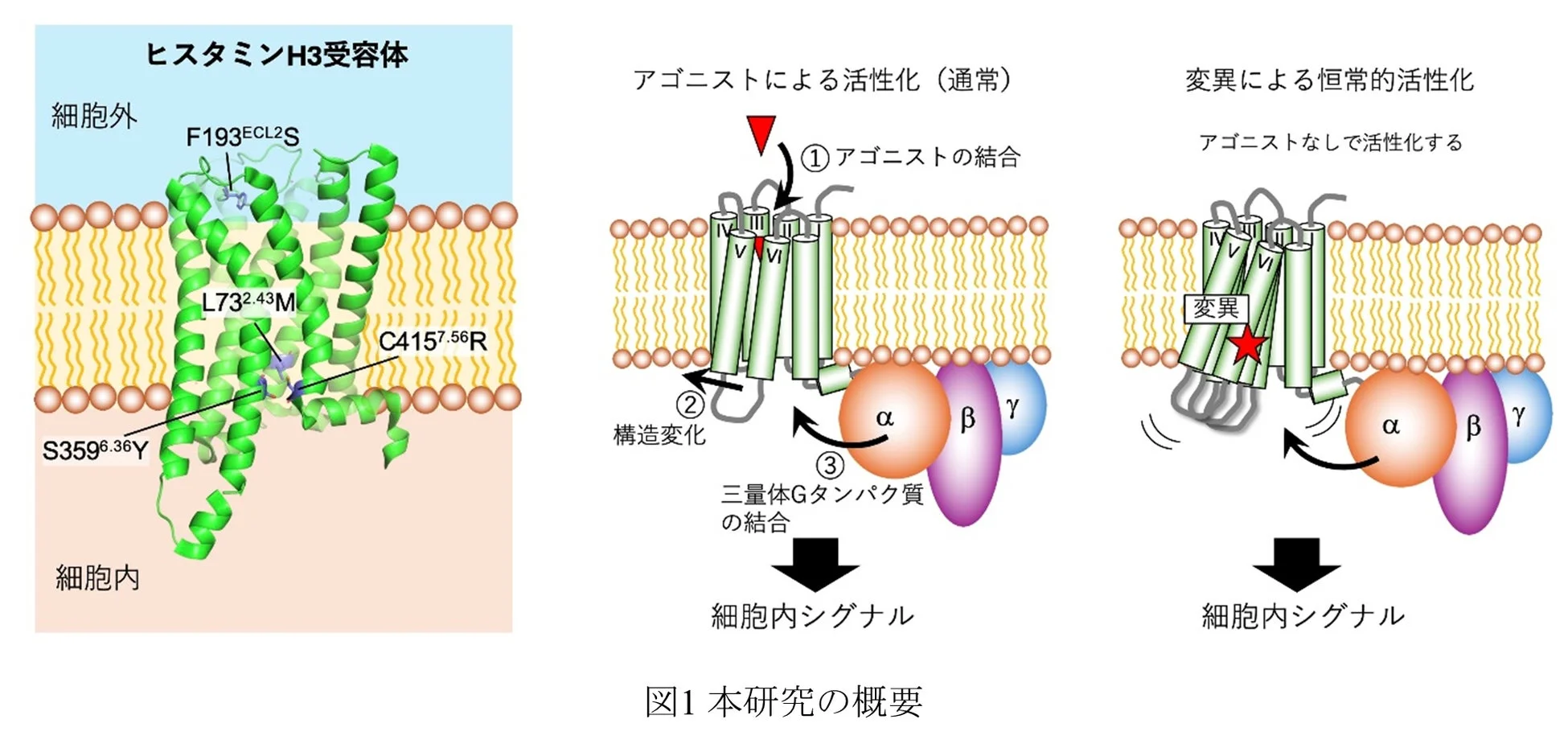
東京理科大学の白石 充典教授、小山 浩舗助教、中島 愛海氏、金子 大斗氏らの研究グループは、以前からH3Rの研究を進めていました。過去の研究で、出芽酵母という酵母細胞でH3Rを発現させても、通常は活性が見られなかったH3Rが、特定の4つのアミノ酸(タンパク質の部品)が変化(変異)することで活性を取り戻すことを発見していました(※1)。
しかし、これらの変異が具体的にどのような仕組みでH3Rの活性に影響を与えているのか、その詳細はまだ謎のままでした。そこで今回の研究では、これらの変異がH3Rの恒常的活性にどう関わっているのか、そしてその構造的な変化を詳しく探ることにしました。
※1: 東京理科大学プレスリリース(2023年10月19日付)「出芽酵母を利用した発現系でヒト由来ヒスタミンH3受容体の活性回復に成功 ~重要な創薬ターゲットであるGタンパク質共役型受容体の機構解明に貢献~」
恒常的活性を制御する「構造決定因子」の解明
今回の研究で明らかになったのは、次の2つの大きなポイントです。
-
4つのアミノ酸変異がH3Rの恒常的活性を著しく増強する
以前に同定されていた4つのアミノ酸変異(L732.43M、F193ECL2S、S3596.36Y、C4157.56R)が、H3Rが常に活性化している状態(恒常的活性)を非常に強くすることを発見しました。これらの変異を複数組み合わせると、さらに活性が強まることも分かりました。 -
受容体の「構造的な不安定化」が活性増強の鍵
恒常的活性の増強は、H3Rの構造が少し不安定になることと深く関係していることが分かりました。通常、受容体は安定した構造を保っていますが、これらの変異が起こることで、受容体が動的な、つまり動きやすい状態になり、それが活性化につながるというわけです。
研究結果の詳細:実験で分かったこと
研究グループは、出芽酵母や哺乳類細胞を使った様々な実験を行いました。
-
恒常的活性の増強:
4つの変異を組み合わせて導入したH3Rでは、すべての組み合わせで恒常的活性が著しく増加しました。また、哺乳類細胞での実験でも、これらの変異を一つずつ導入するだけでも、H3Rの恒常的活性が増強されることが確認されました。これは、細胞の表面にH3Rがたくさん増えたからではなく、H3R自体の性質が変わったことで活性が高まったことを示しています。 -
リガンド結合親和性は変わらない:
「放射性標識リガンド結合実験」という方法で、ヒスタミンがH3Rにどれくらいの強さで結合するかを調べたところ、これらの変異があっても、ヒスタミンとの結合のしやすさは変わらないことが分かりました。つまり、変異はヒスタミンとの結合を介さずに、H3Rを活性化させているということです。 -
構造不安定化のメカニズム:
「FSEC/FSEC-TS解析」という方法でH3Rの構造安定性を調べた結果、すべての変異がH3Rを不安定にすることが分かりました。-
H3Rの膜を貫通している部分にある3つの変異(L732.43M、S3596.36Y、C4157.56R)は、アミノ酸の立体的な衝突が原因で受容体を不安定化させていました。
-
細胞の外側に出ているループ部分の変異(F193ECL2S)は、周囲のアミノ酸との間で安定化に寄与する相互作用(カチオン-π相互作用やπ-π相互作用など)が失われたことで、受容体が不安定になっていました。
-
これらの結果から、H3Rでは、受容体が構造的に少し不安定になることが、恒常的活性の増強につながるという大切な原理が明らかになりました。
- 他のGPCRへの応用可能性:
さらに面白いことに、H3RのC4157.56Rという変異を、H3Rとは配列の似ていない別のGPCRである「H1受容体(H1R)」に導入してみたところ、H1Rの活性が約100倍も向上しました。これは、受容体が違っても、特定の変異が同じように活性化を促進する可能性があることを示しています。
しかし、他の変異(L732.43MやS3596.36Y)はH1Rではほとんど効果がありませんでした。このことは、GPCRの活性化には、受容体間で共通する普遍的な仕組みと、それぞれの受容体に特有の仕組みの両方が存在することを示唆しています。
研究の意義と今後の期待
今回の研究を主導した白石教授は、「以前私たちは、酵母で活性がなかったH3Rに活性を付与する変異を見つけました。これらの変異が受容体にどんな影響を与えるのかを深く知りたくて、今回の研究に至りました。この研究は、将来的に脳の病気をより深く理解したり、副作用の少ない安全な薬を設計したりするための基礎になると思います。また、人工的なGPCRを作る際にも役立つ情報になるでしょう」とコメントしています。
この研究成果は、H3Rだけでなく、GPCR全般の活性化の仕組みを理解する上で非常に重要な一歩となります。GPCRは私たちの体の様々な機能に関わっており、多くの薬のターゲットにもなっています。今回の発見が、将来的には、脳の病気だけでなく、様々な病気の新しい治療薬の開発につながるかもしれません。きっと、多くの人々の健康に貢献する未来が待っていることでしょう。
論文情報
本研究成果は、2025年12月22日に国際学術誌「Protein Science」にオンライン掲載されました。
-
雑誌名: Protein Science
-
論文タイトル: Activity-restoring mutations in the histamine H3 receptor increase constitutive activity and reduce structural stability
-
著者: Ami Nakajima, Hiroto Kaneko, Kosuke Oyama, Misumi Kuchiji, Ayane Itakura, Chiaki Arai, Mitsunori Shiroishi
-
DOI: 10.1002/pro.70408
用語解説
-
恒常的活性:
受容体は通常、特定の物質(リガンド)が結合することで活性化し、細胞内に信号を送ります。しかし、恒常的活性を持つ受容体は、リガンドがなくても自発的に活性化し、常に少しだけ信号を送っている状態のことです。 -
放射性標識リガンド結合実験:
放射性物質で目印をつけたリガンド(今回の場合はヒスタミン)を使って、受容体にリガンドがどれくらいの強さで結合するかを測る実験です。これにより、受容体とリガンドの「親和性(結合のしやすさ)」を数値で知ることができます。 -
FSEC(蛍光検出サイズ排除クロマトグラフィー)/ FSEC-TS(熱安定性シフトアッセイ):
蛍光タンパク質を目印にして、受容体がどれくらい安定しているか、バラバラの状態(単量体)か集まっている状態(オリゴマー)かを調べる方法です。FSEC-TSは、受容体を様々な温度で温めた後にFSECを行うことで、熱に対する安定性を測る方法です。単量体(バラバラの状態)のピークが消えて、より大きな分子のピークに変わると、受容体が不安定になって凝集していることを示します。 -
EC50(50%効果濃度):
薬や化学物質が、最大の効果の半分を出すために必要な濃度を示す数値です。